Dans l'environnement il y a plusieurs types
d'atomes
Chaque atome est différent de tous les autres atomes
L’atome est composé de deux composants
I/le noyau :et celle ci est composé de deux composant qui s'appelé
les nucléons (Le nombre des nucléons noté A)
1/les protons: sont des particules chargée
positivement ; sa charge électrique qp appelée charge
élémentaire est égale à qp= e = 1.6x10-19C
La masse du proton mp est très faible.
Elle est égale à mp=1,67x10-27 Kg
Les protons de tous les noyaux sont identiques, ils ne
différent d’un atome a un autre que par leur nombre (Noté Z)
2/Les neutrons : comme son nom l’indique le
neutron est une particule non chargée
La masse du neutron mn est voisine de celle
du proton. Elle est égale à mn=1,67x10-27Kg
(Le nombre des neutrons notés N)
II/Les électrons
L’électron porte une charge électrique qe négative
égale a l’opposée de la charge élémentaire :
Qe= -e = -1,6x10-19 C
La masse d’un électron est extrêmement faible et vaut
9,1x10-31 Kg
Elle est 1836 fois plus faible que celle du proton.
Les électrons de tous les atomes sont identique, ils
ne différent que par leur nombre
Dans l’états fondamentale le nombre d’électron est égale
a la nombre nombre Z de protons contenus dans le noyau
Remarque : La masse d’un électron est négligeable
Un noyau contenant Z protons a une charge électrique
égale à la somme des charges des protons qui le composent. Comme tous les
protons sont identique et ont le même charge électrique élémentaire e alors, la
charge d’un noyau contenant Z protons sera égale à :
Qnoyau =Zxe
La masse d’un noyau constitué de Z protons et de N
neutrons est donnée par la relation :
M noyau = Z.mp + N mp
Comme les masses du proton et du neutron sont
pratiquement égales on aura :
M noyau=Zmp+Nmp=A.mp=Ax1,67x10-27
Kg
La masse des électrons étant beaucoup plus faible que
celle du noyau on peut considérer que la masse de l’atome est proche a celle do
son noyau.
On a donc matome =Ax1,67x10-27
Kg La masse molaire atomique est pratiquement égale
M=Ax1,67x10-27 N avec N est le nombre d’Avogadro
tel que N=6,02x1023 . Par suite :
M=Ax1,67x10-27x6,02x1023
Kg =Ax10-3 Kg = A.g
On ne constate Donc que le nombre de masse A est
approximativement égal à la valeur de la masse molaire atomique exprimée en
grammes
C’est pour cette raison A est appelée nombre de masse
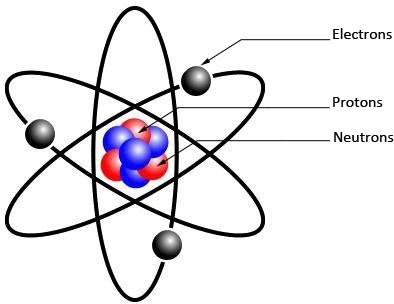
Une image approximative de l'atome
Définition d’un élément chimique
Les atomes et les ions ayant le même nombre de charge
Z correspondant à un même élément chimique
Au cours d’une réaction chimique il y a conservation
des éléments chimiques
Un élément chimique caractérisé par son numéro
atomique Z et par un symbole
Définition des isotopes
Les isotopes d’un élément chimique sont les atomes
dont les noyaux ont le même nombre de charge Z et un nombre de masse A différent

cool
ReplyDelete